Периодический закон Д. И. Mенделеева. Взаимосвязь элементов.
Понятие об элементах как о первичных веществах етришло из глубокой древности и, постепенно видоизменяясь а уточняясь, дошло до нашего времени. Основоположникам научных воззрений на химические элементы являются Р. Бойль (VII в.), М. В. Ломоносов (XVIII в.) и Дальтон (XIX в.).
К началу XIX в. было известно около 30 элементов, к середине XIX в.— около 60. По море накопления числа элементов возникла задача их систематизации. Таких попыток до Д.И. Менделеева было не меньше пятидесяти; за основу систематизации принимались: и атомный вес (ныне называемый атомной массой), и химический эквивалент, и валентность. Подходя к классификации химических элементов метафизически, пытаясь систематизировать только известные в то время элементы, ни один из предшественников Д. И. Менделеева не мог открыть всеобщую взаимосвязь элементов, создать единую стройную систему, отражающую закон развития материи. Эта важная, для науки задача была блестяще разрешена в 1869 г. великим русским ученым Д. И. Менделеевым, открывшим периодический закон.
За основу систематизации Менделеевым были взяты: а) атомный вес и б) химическое сходство между элементами. Наиболее ярким, выразителем сходства свойств элементов является их одинаковая высшая валентность. Как атомный вес (атомная масса), так и высшая валентность элемента представляют собой количественные, числовые константы, удобные для систематизации.
Расположив все известный в то время 63 элемента в ряд по возрастанию атомных масс, Менделеев заметил периодическую повторяемость свойств элементов через неодинаковые промежутки. В результате Менделеевым был создан первый вариант периодической системы.
Закономерный характер изменения атомных масс элементов по вертикалям и горизонталям таблицы, а также образовавшиеся в ней пустые мecта позволили Менделееву смело предсказать наличие n природе ряда элементов, еще не известных в то время науке и даже наметить их атомные массы и основные свойства, исходя из предполагаемого положения элементов в таблице. Это можно било сделать лишь на основе системы, объективно отражающей закон развития материи. Сущность периодического закона Д. И. Менделеев сформулировал в 1869 г.: «Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов (масс) элементов".
Периодическая система элементов.
В 1871 году Д. И. Менделеев дает второй вариант периодической системы (так называемую короткую форму таблицы), в которой он выявляет различные степени родства между элементами. Этот вариант системы дал возможность Менделееву предсказать существование 12 элементов и свойства трех из них описать с очень большой точностью. В период с 1875 по 1886 гг. эти три элемента были открыты и выявилось полное совпадение их свойств с теми, которые были предсказаны великим русским ученым. Эти элементы получили следующие названия: скандий, галлий, германий. После этого периодический закон полечил всеобщее признание как объективный закон природы и ныне является фундаментом химии, физики и других естественных наук.
Периодическая система химических элементов — это графическое выражение периодического закона. Известно, что ряд законов, кроме словесных формулировок, можно изображать графически и выражать математическими формулами. Таков и периодический закон; только присущие ему математические закономерности, о которых будет сказано ниже, не объединены еще общей формулой. Знание периодической системы облегчает изучение курса общей химии.
Конструкция современной периодической системы в принципе мало отличается от варианта 1871 г. Символы элементов в периодической системе расположены по вертикальным и горизонтальным графам. Это приводит к объединению элементов в группы, подгруппы, периоды. Каждый элемент занимает в таблице определенную клетку. Вертикальные графы – это группы (и подгруппы), горизонтальные – периоды (и ряды).
Группой называется совокупность элементов с одинаковой валентностью по кислороду. Эта высшая валентность определяется номером группы. Так как сумма высших валентностей по кислороду н водороду для элементов-неметаллов равна восьми, то по номеру группы легко определить и формулу высшего водородного соединения. Так, для фосфора — элемента пятой группы — высшая валентность по кислороду равна пяти, формула высшего окисла Р2О5, а формула соединения с водородом — РН3. Для серы — элемента шестой группы — формула высшего окисла — SO3, а высшего соединения с водородом — H2S.
Некоторые элементы имеют высшую валентность, не равную номеру их групп. Такими исключениями являются медь Сu, серебро Ag, золото Аu. Они находятся в первой группе, однако их валентности изменяются от одного до трех. Например, имеются соединения: CuO; AgO; Cu2O3; Au2О3. Кислород поставлен в шестую группу, хотя соединения его с валентностью выше двух почти не встречаются. Фтор Р — элемент VII группы — в своих важнейших соединениях одновалентен; бром Вr —элемент VII группы — максимально пятивалентен. Особенно много исключений в VIII группе. В ней только два элемента: рутений Ru и осмий Os проявляют валентность, равную восьми, их высшие окислы имеют формулы RuO4 и OsO4 Валентность же остальных элементов VIII группы значительно ниже.
Первоначально периодическая система Менделеева состояла из восьми групп. В конце XIX в. были открыты инертные элементы, предсказанные русским ученым Н. А. Морозовым, и периодическая система была пополнена девятой по счету группой — нулевой по номеру. Теперь многие ученые считают нужным возвратиться к делению всех элементов снова на 8 групп. Это делает систему более стройной; с позиций октета (восьми) групп яснее становятся некоторые правила и законы.
Элементы группы распределяются по подгруппам. Подгруппа объединяет элементы данной группы, более сходные по своим химическим свойствам. Сходство это зависит от аналогии в строении электронных оболочек атомов элементов. В периодической системе символы элементов каждой из подгрупп располагают строго по вертикали.
В первых семи группах имеется по одной главной и по одной побочной подгруппе; в восьмой группе имеется одна главная подгруппа, «инертные» элементы, и три побочных. Наименование каждой подгруппы обычно дается по названию верхнего элемента, например: подгруппа лития (Li-Na-K-Rb-Cs-Fr), подгруппа хрома (Cr-Mo-W).В то время как элементы одной и той же подгруппы являются химическими аналогам, элементы разных подгрупп одной и той же группы иногда очень резко отличаются по своим свойствам. Общим свойством для элементов главной и побочной подгрупп одной и, той же группы является в основном только одинаковая их высшая валентность по кислороду. Так, марганец Мn и хлор С1, находящиеся в разных подгруппах VII группы, химически не имеют почти ничего общего: марганец — металл, хлор — типичный неметалл. Однако формулы их высших оксидов и отвечающие им гидроокиси аналогичны: Мn2О7 — Cl2O7; НМnО4 - НС1О4.
В периодической системе имеются два горизонтальных ряда по 14 элементов, расположенных вне групп. Обычно их помещают внизу таблицы. Один из этих рядов составляют элементы, названные лантаноидами (буквально: подобные лантану), другой ряд — элементы актиноиды (подобные актинию). Символы актиноидов расположены под символами лантаноидов. Этим расположением выявляются 14 более коротких подгрупп, состоящих из 2 элементов каждая: это вторые побочные, или лантаноидно-актиноидные подгруппы.
На основе всего сказанного различают: а) главные подгруппы, б) побочные подгруппы и в) вторые побочные (лантаноидно-актиноидные) подгруппы.
Следует учесть, что некоторые главные подгруппы также отличаются друг от друга по строению атомов их элементов. Исходя из этого, все подгруппы периодической системы можно разделить на 4 категории.
I. Главные подгруппы I и II групп (подгруппы лития и бериллия).
II. Шесть главных подгрупп III — IV - V — VI — VII — VIII групп (подгруппы бора, углерода, азота, кислорода, фтора и неона).
III. Десять побочных подгрупп (по одной в I — VII группах и три в VIII группе). Jfc,
IV. Четырнадцать лантаноидно-актиноидных подгрупп.
Количества подгрупп этих 4-х категорий составляют арифметическую прогрессию: 2—6—10—14.
Следует отметить, что верхней элемент любой главной подгруппы находится во 2 периоде; верхний элемент любой побочной — в 4 периоде; верхний элемент любой лантаноидно-актиноидной подгруппы - в 6 периоде. Таким образом, с каждым новым четным периодом периодической системы появляются новые категории подгрупп.
Каждый элемент, кроме нахождения в той или иной группе и подгруппе, находится, еще в одном из семи периодов.
Периодом называется такая последовательность элементов, на протяжении которой свойства их изменяются в порядке постепенного усиления от типично металлических до типично неметаллических (металлоидных). Заканчивается каждый период инертным элементом. По мере ослабления металлических свойств у элементов начинают появляться и постепенно усиливаются неметаллические свойства; в середине периодов находятся обычно элементы, совмещающие в той или иной степени как металлические, так и неметаллические свойства. Эти элементы часто называют амфотерными.
Состав периодов.
Периоды не равномерны по числу входящих в них элементов. Первые три называются малыми, остальные четыре — большими. На рис. 8 изображен состав периодов. Число элементов в любом периоде выражается формулой 2п2 где n — целое число. Во 2 и 3 периодах находится по 8 элементов; в 4 и 5 — по 18 элементов; в 6—32 элемента; в 7, еще не законченном, пока 18, элементов, хотя теоретически должно быть тоже 32 элемента.
Оригинален 1 период. В нем только два элемента: водород Н и гелий Не. Переход свойств от металлических до неметаллических совершается:здесь в одном типично амфотерном элементе - водороде. Последний по присущим ему некоторым металлическим свойствам возглавляет подгруппу щелочных металлов, по присущим же ему неметаллическим свойствам — подгруппу галогенов. Водород поэтому часто помещают в периодической системе дважды — в 1 и VII группах.
Различный количественный состав периодов приводит к важному следствию: соседние элементы малых периодов, например углерод С и азот N сравнительно резко отличаются друг от друга по своим свойствам: соседние же элементы больших периодов, например, свинец Pb и висмут Bi, значительно ближе по свойствам друг к другу, так как изменение характера элементов в больших периодах происходит малыми скачками. На отдельных участках больших периодов наблюдается даже столь медленный спад металличности, что рядом стоящие элементы оказываются весьма сходными по своим химический свойствам. Такова, например, триада элементов четвертого периода: железо Fe – кобальт Со – никель Ni, которую часто называют «семейством железа». Сходство по горизонтали (горизонтальная аналогия) перекрывает здесь даже сходство по вертикали (вертикальную аналогию); так, элементы подгруппы железа — железо, рутений, осмий—менее химически сходны между собой, чем элементы «семейства железа».
Наиболее ярким примером горизонтальной аналогии являются.лантаноиды. Все они химически сходны между собой и с лантаном La. В природе они встречаются компаниями, трудно разделяются, типичная высшая валентность большинства их равна 3. У лантаноидов обнаружена особая внутренняя периодичность: каждый восьмой из них по порядку расположения повторяет в некоторой степени свойства и валентные состояния первого, т.е. того из них, от которого начинается отсчет. Так, тербий Тb похож на церий Се; лютеций Lu — на гадолиний Gd.
Актиноиды сходны с лантаноидами, однако горизонтальная аналогия у них проявляется в значительно меньшей степени. Высшая валентность некоторых актиноидов (например, урана U) достигает шести. Принципиально возможная и среди них внутренняя периодичность пока еще не подтверждена.
Расположение элементов в периодической системе. Закон Мозли.
Д. И. Менделеев расположил элементы в определенной последовательности, называемой иногда „Менделеевским рядом". В целом эта последовательность (нумерация) связана с возрастанием атомных масс элементов. Однако имеются и исключения. Иногда логичный ход изменения валентности находится в противоречии с ходом изменения атомных масс. В таких случаях необходимость требовала отдать предпочтение какой-либо одной из этих двух основ систематизации. Д. И. Менделеев в отдельных случаях нарушал принцип расположения элементов но возрастающим атомным массам и опирался на химическую аналогию между элементами. Если бы Менделеев поместил никель Ni перед кобальтом Со, йод I перед теллуром Те, то эти элементы попали бы в подгруппы и группы, не соответствующие, их свойствам, и их высшей валентности.
В 1913 г. английский ученый Г. Мозли, исследуя спектры лучей Рентгена для различных элементов, подметил закономерность, связывающую номера элементов в периодической системе Менделеева с длиной волн этих лучей, получившихся в результате облучения тех или иных элементов катодными тучами. Оказалось, что квадратные корни из обратных значений длин волн этих лучей 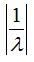 связаны линейной зависимостью с порядковыми номерами соответствующих элементов. Закон Г. Мозли позволил проверить правильность „Менделеевского ряда" и подтвердил его безупречности.
связаны линейной зависимостью с порядковыми номерами соответствующих элементов. Закон Г. Мозли позволил проверить правильность „Менделеевского ряда" и подтвердил его безупречности.
Пусть, например, известны значения 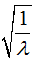 для элементов № 20 и №30, номера которых в системе сомнений у нас не вызывают. Эти значения связаны с указанными номерами линейной зависимостью. Для проверки, например, правильности номера, присвоенного кобальту (27), и судя по атомной массе, этот номер должен был бы иметь никель, его облучают катодными лучами: в результате из кобальта выделяются лучи Рентгена. Разложением их на подходящих дифракционных решетках (на кристаллах) получаем спектр этих лучей и, выбрав наиболее четкую из спектральных линий, измеряем длину волны (
для элементов № 20 и №30, номера которых в системе сомнений у нас не вызывают. Эти значения связаны с указанными номерами линейной зависимостью. Для проверки, например, правильности номера, присвоенного кобальту (27), и судя по атомной массе, этот номер должен был бы иметь никель, его облучают катодными лучами: в результате из кобальта выделяются лучи Рентгена. Разложением их на подходящих дифракционных решетках (на кристаллах) получаем спектр этих лучей и, выбрав наиболее четкую из спектральных линий, измеряем длину волны (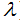 ) луча, соответствующего этой линии; затем откладываем на ординате значение
) луча, соответствующего этой линии; затем откладываем на ординате значение 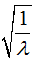 . Из полученной точки А проводим прямую, параллельную оси абсцисс, до пересечения с выявленной ранее прямой. Из точки пересечения Б опускаем перпендикуляр на ось абсцисс: он точно укажет нам номер кобальта, равный 27. Так, периодическая система элементов Д. И. Менделеева - плод логических умозаключений ученого - получила экспериментальное подтверждение.
. Из полученной точки А проводим прямую, параллельную оси абсцисс, до пересечения с выявленной ранее прямой. Из точки пересечения Б опускаем перпендикуляр на ось абсцисс: он точно укажет нам номер кобальта, равный 27. Так, периодическая система элементов Д. И. Менделеева - плод логических умозаключений ученого - получила экспериментальное подтверждение.
Современная формулировка периодического закона. Физический смысл порядкового номера элемента.
После работ Г. Мозли атомная масса элемента постепенно начала уступать свою первенствующую роль новой, еще не ясной по своему внутреннему (физическому) смыслу, но более четкой константе — порядковому или, как теперь называют, атомному номеру элемента. Физический смысл этой константы был выявлен в 1920 г. работами английского ученого Д.Чедвика. Д. Чёдвик экспериментально установил, что порядковый номер элемента численно равен величине положительного заряда Z ядра атома этого элемента, т. е. количеству протонов в ядре. Оказалось, что Д. И. Менделеев, сам того не подозревая, расставил элементы в последовательности, точно соответствующей возрастанию заряда ядер их атомов.
К этому же времени было также установлено, что атомы одного и того же элемента могут отличаться друг от друга своей массой; такие атомы получили название изотопов. Примером могут служить атомы: 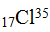 и
и 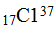 . В периодической системе изотопы одного и того же элемента занимают одну клетку. В связи с открытием изотопов было уточнено понятие химический элемент. В настоящее время химическим элементом называют вид атомов, имеющих одинаковый заряд ядра - одинаковое количество протонов в ядре. Была уточнена и формулировка периодического закона. Современная формулировка закона гласит: свойства элементов и их соединений находятся в периодической зависимости от величины, заряда ядер их атомов.
. В периодической системе изотопы одного и того же элемента занимают одну клетку. В связи с открытием изотопов было уточнено понятие химический элемент. В настоящее время химическим элементом называют вид атомов, имеющих одинаковый заряд ядра - одинаковое количество протонов в ядре. Была уточнена и формулировка периодического закона. Современная формулировка закона гласит: свойства элементов и их соединений находятся в периодической зависимости от величины, заряда ядер их атомов.
Периодически изменяются и другие характеристики элементов, связанные со строением внешних электронных слоев атомов, атомные объемы, энергия ионизации и другие свойства.
Периодическая система и строение электронных оболочек атомов элементов.
В дальнейшем было установлено, что не только порядковый номер элемента имеет глубокий физический смысл, но и другие понятия, ранее рассмотренные ранее также постепенно приобретали физический смысл. Например, номер группы, указывая на высшую валентность элемента, выявляет тем самым максимальное число электронов атома того или иного элемента, которое может участвовать в образовании химической связи.
Номер периода, в свою очередь, оказался связанным с числом энергетических уровней, имеющихся в электронной оболочке атома элемента данного периода.
Таким образом, например, „координаты" олова Sn (порядковый номер 50, 5 период, главная подгруппа IV группы), означают, что электронов в атоме олова 50, распределены они на 5 энергетических уровнях, валентными являются лишь 4 электрона.
Физический смысл нахождения элементов в подгруппах различных категорий чрезвычайно важен. Оказывается, что у элементов, расположенных в подгруппах I категории, очередной (последний) электрон располагается на s-подуровне внешнего уровня. Эти элементы относят к электронному семейству. У атомов элементов, расположенных в подгруппах II категории, очередной электрон располагается на р-подуровне внешнего уровня. Это, элементы электронного семейства „р". Так, очередной 50-й электрон у атомов олова располагается на р-подуровне внешнего, т. е. 5-го энергетического уровня.
У атомов элементов подгрупп III категории очередной электрон располагается на d-подуровне, но уже пред внешнего уровня, это элементы электронного семейства «d». У атомов лантаноидов и актиноидов очередной электрон располагается на f-подуровне, пред пред внешнего уровня. Это элементы электронного семейства «f».
Не случайно, следовательно, отмеченные выше числа подгрупп этих 4-х категорий, то есть 2-6—10—14, совпадают с максимальными числами электронов на подуровнях s-p-d-f.
Но можно, оказывается, решить вопрос о порядке заполнения электронной оболочки и вывести электронную формулу для атома любого элемента и на основе периодической системы, которая с достаточной ясностью указывает уровень и подуровень каждого очередного электрона. Периодическая система указывает и на размещение одного за другим элементов по периодам, группам, подгруппам и на распределение их электронов по уровням и подуровням, потому что каждому элементу соответствует свой собственный, характеризующий его последний электрон. В качестве примера разберем составление электронной формулы для атома элемента циркония (Zr). Периодическая система дает показатели и „координаты" этого элемента: порядковый номер 40, период 5, группа IV, побочная подгруппа. Первые выводы: а) всех электронов 40, б) эти 40 электронов распределены на пяти энергетических уровнях; в) из 40 электронов только 4 являются валентными, г) очередной 40-й электрон поступил на d-подуровень пред внешнего, т. е. четвертого энергетического уровня. Подобные выводы можно сделать о каждом из 39 элементов, предшествующих цирконию, только показатели и координаты будут каждый раз иными.
Поэтому методический прием составления электронных формул элементов на основе периодической системы и состоит в том, что мы последовательно рассматриваем электронные оболочка каждого элемента по пути к заданному, выявляя по его «координатам", куда направился в оболочке его очередной электрон.
Первые два элемента первого периода водород Н и гелий Не относятся к s-семейству. Их электроны в числе двух поступают на s-подуровень первого уровня. Записываем: 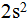 Певый период на этом заканчивается, первый энергетический уровень также. Следующие по порядку два элемента второго периода - литий Li и бериллий Be находятся в главных подгруппах I и II групп. Это также s-элементы. Их очередные электроны расположатся на s подуровне 2-го уровня. Записываем
Певый период на этом заканчивается, первый энергетический уровень также. Следующие по порядку два элемента второго периода - литий Li и бериллий Be находятся в главных подгруппах I и II групп. Это также s-элементы. Их очередные электроны расположатся на s подуровне 2-го уровня. Записываем 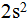 Далее следуют подряд 6 элементов 2-го периода: бор В, углерод С, азот N, кислород О, фтор F и неон Ne. Согласно местонахождению этих элементов в главных подгруппах Ш — Vl групп их очередные электроны в числе шести будут располагаться на р-подуровне 2-го уровня. Записываем:
Далее следуют подряд 6 элементов 2-го периода: бор В, углерод С, азот N, кислород О, фтор F и неон Ne. Согласно местонахождению этих элементов в главных подгруппах Ш — Vl групп их очередные электроны в числе шести будут располагаться на р-подуровне 2-го уровня. Записываем: 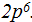 Инертным элементом неоном второй период заканчивается, второй энергетический уровень также закончен. Далее следуют два элемента третьего периода главных подгрупп I и II групп: натрий Na и магний Mg. Это s-элементы и их очередные электроны располагаются на s-подуровне 3-го уровня
Инертным элементом неоном второй период заканчивается, второй энергетический уровень также закончен. Далее следуют два элемента третьего периода главных подгрупп I и II групп: натрий Na и магний Mg. Это s-элементы и их очередные электроны располагаются на s-подуровне 3-го уровня 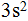 Затем идут шесть элементов 3-го периода: алюминий Аl, кремний Si, фосфор Р, сера S, хлор С1, аргон Аr. Согласно нахождению этих элементов в главных подгруппах III — УI групп их очередные электроны в числе шести расположатся на р-подуровне 3-го уровня —
Затем идут шесть элементов 3-го периода: алюминий Аl, кремний Si, фосфор Р, сера S, хлор С1, аргон Аr. Согласно нахождению этих элементов в главных подгруппах III — УI групп их очередные электроны в числе шести расположатся на р-подуровне 3-го уровня — 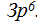 Инертным элементом аргоном 3-й период закончен, но 3-й энергетический уровень еще не закончен, пока отсутствуют электроны на его третьем возможном d-подуровне.
Инертным элементом аргоном 3-й период закончен, но 3-й энергетический уровень еще не закончен, пока отсутствуют электроны на его третьем возможном d-подуровне.
Далее следуют 2 элемента 4-го периода главных подгрупп I и II групп: калий К и кальций Са. Это снова s-элементы. Их очередные электроны будут находиться на s-подуровне, но уже 4-го уровня. Этим очередным электронам энергетически выгоднее начать заполнять более удаленный от ядра 4-й уровень, нежели заполнять подуровень 3d. Записываем: 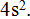 Десять следующих элементов 4-го периода от № 21 скандия Sc до № 30 цинка Zn находятся в побочных подгруппах III — V — VI — VII — VIII — I — II групп. Так как все они являются d-элементами, то их очередные электроны располагаются на d-подуровне пред внешнего уровня т. е. третьего от ядра. Записываем:
Десять следующих элементов 4-го периода от № 21 скандия Sc до № 30 цинка Zn находятся в побочных подгруппах III — V — VI — VII — VIII — I — II групп. Так как все они являются d-элементами, то их очередные электроны располагаются на d-подуровне пред внешнего уровня т. е. третьего от ядра. Записываем: 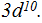
Следующие шесть элементов 4-го периода: галлий Ga, германий Ge, мышьяк As, селен Se, бром Вr, криптон Кr — находятся в главных подгруппах III — VIIJ групп. Их очередные 6 электронов располагаются на р-подуровне внешнего, т. е. 4-го уровня: 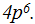 Рассмотрены 3б элементов; четвертый период закончен инертным элементом криптоном; закончен и 3-й энергетический уровень. Однако на 4 уровне полностью заполнены лишь два подуровня: s и р (из 4-х. возможных).
Рассмотрены 3б элементов; четвертый период закончен инертным элементом криптоном; закончен и 3-й энергетический уровень. Однако на 4 уровне полностью заполнены лишь два подуровня: s и р (из 4-х. возможных).
Далее следуют 2 элемента 5-го периода главных подгрупп I и II групп: № 37 рубидий Rb и № 38 стронций Sr. Это элементы s-семейства, и их очередные электроны располагаются на s-подуровне 5-го уровня: 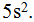 Последние 2 элемента — № 39 иттрий YU № 40 цирконий Zr — находятся уже в побочных подгруппах, т. е. принадлежат к d-семейству. Два их очередных электрона направятся на, d-подуровень, пред внешнего, т.е. 4-го уровня
Последние 2 элемента — № 39 иттрий YU № 40 цирконий Zr — находятся уже в побочных подгруппах, т. е. принадлежат к d-семейству. Два их очередных электрона направятся на, d-подуровень, пред внешнего, т.е. 4-го уровня 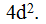 Суммируя последовательно все записи, составляем электронную формулу для атома циркония № 40
Суммируя последовательно все записи, составляем электронную формулу для атома циркония № 40 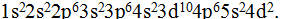 Выведенную электронную формулу для атома циркония можно несколько видоизменить, расположив подуровни в порядке нумерации их уровней:
Выведенную электронную формулу для атома циркония можно несколько видоизменить, расположив подуровни в порядке нумерации их уровней:
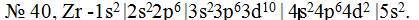
Выведенную формулу можно, разумеется, и упростить, в распределение электронов лишь по энергетическим уровням: Zr – 2|8| 18 |8 + 2| 2 (стрелкой указано место вступления очередного электрона; подчеркнуты валентные электроны). Физический смысл категории подгрупп заключается не только в различии места вступления очередного электрона в оболочку атома, но и в том, на каких уровнях расположены валентные электроны. Из сопоставления упрощенных электронных формул, например, хлора (3-й период, главная подгруппа VII группы), циркония (5-й период, побочная подгруппа IV группы) и урана (7-й период, подгруппа лантаноидно-актиноидная)
№17, С1—2|8|7
№40, Zr — 2|8|18|8+ 2| 2
№92, U — 2|8|18 | 32 |18 + 3|8 + 1|2
видно, что у элементов любой главной подгруппы валентными могут быть лишь электроны внешнего уровня (s и р). У элементов побочных подгрупп валентными могут быть электроны внешнего и частично пред внешнего уровня (s и d). У лантаноидов и особенно актиноидов валентные электроны могут находиться на трех уровнях: внешнем, пред внешнем и пред пред внешнем. Как правило, общее число валентных электронов равно номеру группы.
Свойства элементов. Энергия ионизации. Энергия сродства к электрону.
Сравнительное рассмотрение свойств элементов осуществляется по трем возможным направлениям периодической системы: а) горизонтальному (по периоду), б) вертикальному (по подгруппе), в) диагональному. Для упрощения рассуждений исключим 1-й период, незаконченный 7-й, а также всю VIII группу. Останется основной параллелограмм системы, в верхнем левом углу которого будет находится литий Li (№3), в нижнем левом – цезий Сs (№55). В правом верхнем – фтор F (№9), в правом нижнем – астат Аt (№85).
направлениям. По горизонтальному направлению слева направо объемы, атомов постепенно уменьшаются; происходит, это в результате влияния увеличения заряда ядра на электронную оболочку. По вертикальному направлению сверху вниз в результате увеличения числа уровней объемы атомов постепенно возрастают; по диагональному направлению — значительно менее отчетливо выраженному и более короткому - остаются близкими. Это общие закономерности, из которых, как всегда, имеются и исключения.
В главных подгруппах по мере увеличения объемов атомов, т. е. сверху вниз, облегчается отщепление внешних электронов и затрудняется присоединение к атомам новых электронов. Отдача электронов характеризует так называемую восстановительную способность элементов, особенно типичную для металлов. Присоединение же электронов характеризует окислительную способность, - типичную для неметаллов. Следовательно, сверху вниз в главных подгруппах восстановительная способность атомов элементов возрастает; увеличиваются и металлические свойства простых тел, соответствующих этим элементам. Окислительная же способность уменьшается.
Слева направо по периодам картина изменений противоположная: восстановительная способность атомов элементов уменьшается, окислительная же — увеличивается; увеличиваются неметаллические свойства простых тел, соответствующих этим элементам.
По диагональному направлению свойства элементов остается более или менее близкими. Рассмотрим это направление на примере: бериллий—алюминий [Be —Al]
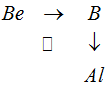 От бериллия Be к алюминию Al можно перейти непосредственно по диагонали Ве → А1, можно и через бор В, т. е. по двум катетам Be → В и В → А1. Усиление неметаллических свойств от бериллия к бору и ослабление их от бора к алюминию объясняет, почему элементы бериллий и алюминий, расположенные по диагонали, имеют некоторую аналогию в свойствах, хотя они и не стоят в одной подгруппе периодической системы.
От бериллия Be к алюминию Al можно перейти непосредственно по диагонали Ве → А1, можно и через бор В, т. е. по двум катетам Be → В и В → А1. Усиление неметаллических свойств от бериллия к бору и ослабление их от бора к алюминию объясняет, почему элементы бериллий и алюминий, расположенные по диагонали, имеют некоторую аналогию в свойствах, хотя они и не стоят в одной подгруппе периодической системы.
Таким образом, между периодической системой, строением атомов элементов и их химическими свойствами существует тесная связь.
Свойства атома любого элемента — 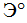 отдавать электрон и превращаться в положительно заряженный ион —
отдавать электрон и превращаться в положительно заряженный ион — 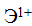 оцениваются количественно затратой энергии, называемой энергией ионизации I*. Ее выражают в ккал/г-атом или хдж/г-атом.
оцениваются количественно затратой энергии, называемой энергией ионизации I*. Ее выражают в ккал/г-атом или хдж/г-атом.
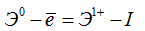
Чем меньше эта энергия, тем атом элемента сильнее проявляет восстановительные свойства, тем элемент металличнее; чем больше этa энергия, тем металлические свойства слабее, тем сильнее у элемента проявляются неметаллические свойства. Свойство атома любого элемента принимать электрон и превращаться при этом в отрицательно заряженный ион оценивается количеством выделяющейся энергии, называемой энергичней сродства к электрону Е; ее также выражают в ккал/г-атом или кдж/г-атом.
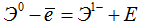
Сродство к электрону может служить мерой способности элемента проявлять неметаллические свойства. Чем больше эта энергия, тем элемент неметалличнее, и, наоборот, чем энергия меньше, тем элемент металличнее.
Часто для характеристики свойств элементов используют величину, которая называется электроотрицательностью.
Она: представляет собой арифметическую сумму величин энергии ионизации и энергии сродства к электрону
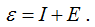
Константа является мерой неметалличности элементов. Чем она больше, тем сильнее элемент проявляет неметаллические свойства.
Следует учитывать, что все элементы по сути дела двойственны по природе. Деление элементов на металлы и неметаллы до известной степени условно, ибо в природе нет резких граней. С усилением у элемента металлических свойств происходит ослабление его неметаглических свойств и наоборот. Самый „металличный" из элементов — франций Fr — можно считать наименее неметалличным, самый „неметалличный" — фтор F — можно считать наименее металличным.
Суммируя значения вычисленных энергий — энергии ионизации и энергии сродства к электрону, — мы получим: для цезия величину
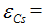 90 ккал/г-а., для лития
90 ккал/г-а., для лития 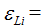 128 ккал\г-а., для фтора
128 ккал\г-а., для фтора 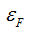 = 510 ккал1г-а. (величину выражают и в кдж/г-а.). Это — абсолютные значения электроотрицательности. Для упрощения пользуются относительными значениями электроотрицательности, принимая электроотрицательность лития (128) за единицу. Тогда для фтора (F) получим:
= 510 ккал1г-а. (величину выражают и в кдж/г-а.). Это — абсолютные значения электроотрицательности. Для упрощения пользуются относительными значениями электроотрицательности, принимая электроотрицательность лития (128) за единицу. Тогда для фтора (F) получим: 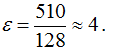
Для цезия (Cs) относительная электроотрицательность будет равна
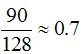
На графике изменения электроотрицательности элементов главных подгрупп
I—VII групп. сопоставлены электроотрицательности элементов главных подгрупп I—VII групп. Приведенные данные указывают на истинное положение водорода в 1-ом периоде; неодинаковое возрастание металличности элементов, сверху вниз по различным подгруппам; некоторое сходство элементов: водорода — фосфора — теллура (
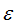 = 2,1), бериллия и алюминия (
= 2,1), бериллия и алюминия (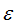 =1,5) и ряда других элементов. Как видно из приведенных сопоставлений, используя значения электроотрицательности, можно приближенно сравнивать между собой, элементы даже разных подгрупп, и разных периодов.
=1,5) и ряда других элементов. Как видно из приведенных сопоставлений, используя значения электроотрицательности, можно приближенно сравнивать между собой, элементы даже разных подгрупп, и разных периодов.
График изменения эдектроотрицательностн элементов главных подгрупп I—VII групп.
Периодический закон и периодическая система элементов имеют огромное философское, научное и методологическое значения. Они являются: средством познания окружающего нас мира. Периодический закон вскрывает и отражает диалектико-материалистическую сущность природы. Периодический, закон и периодическая система элементов со всей убедительностью доказывают единство и материальность окружающего нас мира. Они являются лучшим подтверждением справедливости основных черт марксистского диалектического метода познания: а) взаимосвязи и взаимозависимости предметов и явлений, б) непрерывности движения и развития, в) перехода количественных изменений в качественные, г) борьбы и единства противоположностей.
Огромное научное значение периодического закона заключается в том, что он помогает творческим открытиям в области химических, физических, минералогических, геологических, технических и других наук. До открытия периодического закона химия представляла собой скопление разрозненных, лишенных внутренней связи фактических сведений; теперь все это приведено в единую стройную систему. Многие открытия в области химии и физики были сделаны на основе периодического закона и периодической системы элементов. Периодический закон открыл путь к познанию внутреннего строения атома и его ядра. Он обогащается все новыми открытиями и подтверждается как незыблемый, объективный закон природы. Большое методологическое и методическое значение периодического закона и периодической системы элементов заключается в том, что при изучении химии они дают возможность развивать у студента диалектико-материалистическое мировоззрение и облегчают усвоение курса химии: Изучение химии следует строить не на запоминании свойств отдельных элементов и их соединений, а судить о свойствах простых и сложных веществ, исходя из закономерностей, выраженных периодическим законом и периодической системой элементов.
